Module 4 Opheffen van beschermende maatregelen
Uitgangsvraag
Wanneer kunnen beschermende maatregelen van patiënten en medewerkers worden opgeheven?
Aanbevelingen
Aanbevelingen patiënten (zie ook figuur 4.1)
Bewezen MRSA (meticilline-resistente Staphylococcus aureus )-dragerschap (risicocategorie 1)
- Verlaag MRSA-risicocategorie 1 naar risicocategorie 3 als:
- Minimaal drie opeenvolgende MRSA-testen (sets)* negatief zijn met tussenpozen van minimaal zeven dagen;
én - De patiënt tijdens en minstens 48 uur voorafgaand aan de afname van materiaal voor de MRSA-test* geen antibiotica gebruikte, waarvoor de desbetreffende MRSA-stam gevoelig is zoals vermeld in het antibiogram. Controlekweken kunnen wel worden afgenomen onder gebruik van betalactam-antibiotica, waartegen MRSA-resistent is.
- Minimaal drie opeenvolgende MRSA-testen (sets)* negatief zijn met tussenpozen van minimaal zeven dagen;
- Verklaar de patiënt MRSA-vrij en verwijder risicocategorie 3 uit het patiëntdossier als:
- Minimaal drie opeenvolgende MRSA-testen (sets)* negatief zijn met tussenpozen van minimaal zeven dagen; de MRSA-test* negatief is afgenomen op twee maanden en minimaal één jaar na de eerste MRSA-test*;
én - De patiënt tijdens en minstens 48 uur voorafgaand aan de afname van materiaal voor de MRSA-test* geen antibiotica gebruikte, waarvoor de desbetreffende MRSA-stam gevoelig is zoals vermeld bij het antibiogram. Controlekweken kunnen wel worden afgenomen onder gebruik van betalactam-antibiotica, waartegen MRSA resistent is.
- Minimaal drie opeenvolgende MRSA-testen (sets)* negatief zijn met tussenpozen van minimaal zeven dagen; de MRSA-test* negatief is afgenomen op twee maanden en minimaal één jaar na de eerste MRSA-test*;
Hoog risico op MRSA-dragerschap (risicocategorie 2)
- De voorgeschreven maatregelen kunnen worden beëindigd als de inventarisatiekweken negatief zijn, of als de MRSA-PCR-sneltest van tenminste de neus en één andere locatie negatief zijn.
- Bij persisterend risico blijft de patiënt risicocategorie 3 en zijn de uitslagen geldig gedurende maximaal drie maanden en is het afnemen van een nieuwe MRSA-test binnen deze drie maanden* niet noodzakelijk.
- Na drie maanden (of eerder als dat regionaal zo is afgestemd) valt de patiënt weer in risicocategorie 2 en is het afnemen van nieuwe screeningskweken noodzakelijk.
- Voor een eenduidig beleid naar patiënten is het gewenst om bij een persisterend risico de duur van de geldigheid van een negatieve MRSA-negatieve kweekset af te stemmen binnen de ABR-zorgregio.
Aanbevelingen medewerkers (zie ook figuur 4.1)
- Verklaar de medewerker MRSA-vrij als:
- Minimaal drie opeenvolgende MRSA-testen (sets)* negatief zijn met tussenpozen van minimaal zeven dagen; de MRSA-test* negatief is afgenomen op twee maanden en minimaal één jaar na de eerste MRSA-test*;
én - De medewerker tijdens en minstens 48 uur voorafgaand aan de afname van materiaal voor de MRSA-test* geen antibiotica gebruikte waarvoor de desbetreffende MRSA-stam gevoelig is, zoals vermeld bij het antibiogram. Controlekweken kunnen wel worden afgenomen onder gebruik van betalactam-antibiotica, waartegen MRSA resistent is.
- Minimaal drie opeenvolgende MRSA-testen (sets)* negatief zijn met tussenpozen van minimaal zeven dagen; de MRSA-test* negatief is afgenomen op twee maanden en minimaal één jaar na de eerste MRSA-test*;
- Sta MRSA-dragers toe, na een initieel werkverbod tot de uitslag van de typering bekend is (en na start van dragerschapsbehandeling), om in de directe patiëntenzorg te werken onder de volgende voorwaarden en in overleg met de bedrijfsarts, arts-microbioloog en/of deskundige infectiepreventie:
- De medewerker ondergaat op indicatie (bij afwezigheid van contra-indicaties zoals uitgebreide huidlaesies of persisterende blootstelling) een MRSA-dragerschapsbehandeling.
- De medewerker heeft geen huidafwijkingen, zoals bijvoorbeeld (chronisch/opvlammend) eczeem en/of chronische wonden.
- De medewerker meldt zich bij de bedrijfsarts als er huidafwijkingen ontstaan.
- De medewerker is geen drager van een epidemische stam en/of stam die PVL-positief is.
- De medewerker committeert zich aan bron- en contactonderzoek.
* Voor de afname van kweekmaterialen en het uitvoeren van MRSA-testen verwijst de werkgroep naar de richtlijn Laboratoriumdetectie bijzonder resistente micro-organismen (BRMO)
Overwegingen
Zoals beschreven in module 1 van deze richtlijn wordt er in Nederland voor MRSA een actief ‘search en destroy’ beleid gevolgd. Dit houdt in dat er bij opname in een zorginstelling actief naar MRSA gezocht wordt. Patiënten of medewerkers die mogelijk MRSA bij zich dragen worden op basis van het risico op dragerschap van MRSA ingedeeld in risicocategorieën (zie module 2). Afhankelijk van deze risicocategorieën worden er ook beschermende maatregelen genomen. Het opheffen van deze maatregelen gebeurt conform een aantal vaste afspraken en dit beleid is succesvol gebleken (Wertheim, 2004; Vos, 2005; Vos, 2009; van Rijen, 2009; Ammerlaan, 2011, Nethmap 2021, Maan, 2021).
Negatieve MRSA-testen
Voor de afname van kweekmaterialen en het uitvoeren van MRSA-testen verwijst de werkgroep naar de richtlijn Laboratoriumdetectie bijzonder resistente micro-organismen. Afhankelijk van het soort antibiotica dat een persoon gebruikt, kan het zo zijn dat de MRSA niet opgepikt wordt in de detectiemethoden als MRSA voor die betreffende antibiotica wel gevoelig is. Als gevolg hiervan zou een patiënt ten onrechte als MRSA-negatief kunnen worden beschouwd. Om een fout-negatieve MRSA-test te voorkomen dient een persoon daarom geen antibiotica gebruiken waarvoor MRSA gevoelig zou zijn tijdens en minstens 48 uur voorafgaand aan de afname van materiaal voor de MRSA-test.
Personen met risico op MRSA-dragerschap
In geval van een hoog risico op MRSA-dragerschap, risicocategorie 2 (zie module 2) kunnen de voorgeschreven maatregelen ten aanzien van MRSA worden beëindigd als de kweken negatief blijken te zijn of als de MRSA-PCR-sneltest van tenminste de neus en één andere locatie negatief blijken te zijn (uiteraard zonder positieve resultaten van de sneltest van andere materialen) (Kluytmans-van den Bergh 2013). Voor personen met persisterend hoog risico op MRSA-dragerschap geldt dat een negatieve kweekset een beperkte geldigheidsduur heeft. Het is niet bekend hoe lang een negatieve MRSA-kweekset als geldig kan worden beschouwd. Naar het oordeel van de werkgroep in ieder geval niet langer dan drie maanden. Gedurende deze drie maanden hoeven maatregelen niet te worden genomen. Daarna is een nieuwe negatieve kweekset vereist. Ten behoeve van een eenduidig beleid naar patiënten is het gewenst om de duur van de geldigheid van een negatieve MRSA-negatieve kweekset af te stemmen binnen de ABR-zorgregio. Zie voor groepen met een persisterend verhoogd risico module 2.
Personen met bewezen MRSA-dragerschap
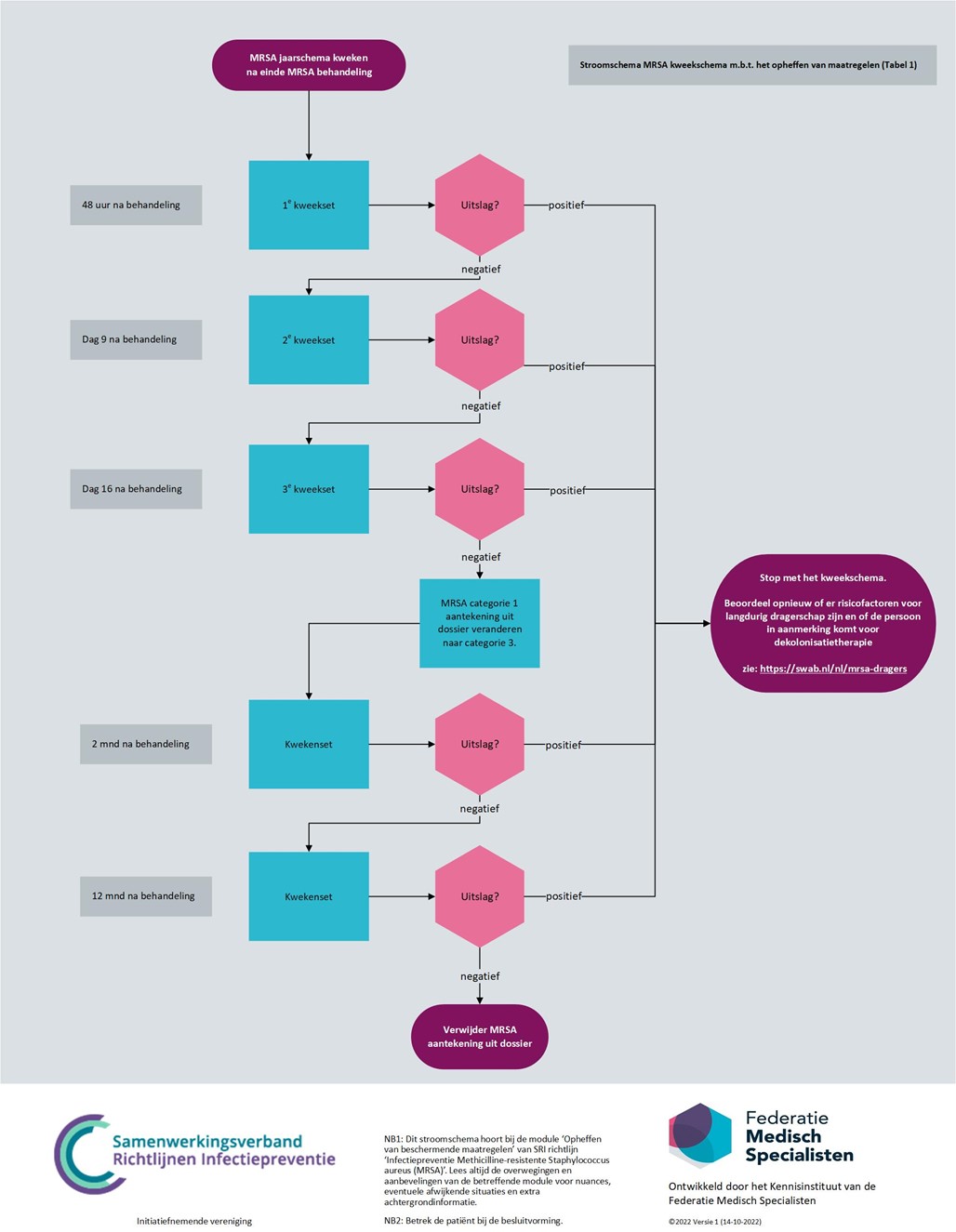
Als onderdeel van het search en destroy beleid wordt het effect van de dragerschapsbehandeling (eradicatie) bij patiënten met MRSA-dragerschap gecontroleerd door het afnemen van controlekweken. Als gevolg van behandeling bestaat er echter een kans op het terugdringen van MRSA tot onder de detectiegrens, zonder dat er sprake is van volledige eradicatie, zodat na verloop van tijd de MRSA weer kan uitgroeien. Om de kans op een fout-negatieve controlekweek en/of sampling error te verkleinen dienen er na de dragerschapsbehandeling minimaal drie sets kweken te worden afgenomen met een tussenpoos van zeven dagen voor de beschermende maatregelen opgeheven worden. Ter controle volgt nog een set kweken na twee maanden en een set kweken na twaalf maanden. In principe kan na twaalf maanden het label verwijderd worden. Er kunnen echter redenen zijn om bij patiënten met risicofactoren voor langdurig dragerschap het label langer te handhaven.
Om een fout-negatieve-MRSA-test te voorkomen, dient de persoon tijdens en minstens 48 uur voorafgaand aan de afname van materiaal voor de MRSA-tests geen antibiotica te gebruiken waarvoor de desbetreffende MRSA-stam gevoelig is. Zie figuur 4.1 voor een kweekschema met betrekking tot het opheffen van maatregelen. Voor bekend MRSA-positieve personen zonder risicofactoren voor langdurig dragerschap die langere tijd (langer dan een jaar) uit beeld zijn geweest kan afhankelijk van de omstandigheden gekozen worden om ook dit schema te volgen of in overleg met de deskundige infectiepreventie en/of arts-microbioloog maatwerk te leveren met een ingekort schema.
Figuur 4.1: MRSA-kweekschema over het opheffen van maatregelen
Langdurige zorg en wijkverpleging
Voor de langdurige zorg en de wijkverpleging wordt op onderdelen een soepeler beleid gehanteerd dan in het ziekenhuis. Enerzijds omdat de antibioticumdruk in het ziekenhuis hoger is dan in de langdurige zorg en de wijkverpleging en er in het ziekenhuis door de intensiteit van de medische en verpleegkundige zorg een verhoogd risico is op verspreiding van MRSA. Anderzijds zijn isolatiemaatregelen erg ingrijpend in de persoonlijke leefomgeving van cliënten in de langdurige zorg waarbij ook vaak sprake is van een blijvende woonsituatie. De maatregelen dienen proportioneel te zijn, met daarbij een afweging van het risico op verspreiding en de belasting en impact (= kans op ernstig verloop) tegen de kwaliteit van leven.
Afhankelijk van de situatie en cliëntkenmerken (kan de cliënt bijvoorbeeld hygiënisch omgaan met lichaamsvloeistoffen zoals speeksel, luchtwegsecreet, urine, ontlasting of met geïnfecteerde wonden of lichaamsopeningen), kan maatwerk worden geleverd en kunnen maatregelen en het opheffen daarvan na multidisciplinair overleg mogelijk versoepeld worden.
Als er sprake is van langdurig/blijvend dragerschap kan in overleg met bewoner en/of familie samen met behandelaar(s) en zorgverleners te worden gekeken naar verdere versoepeling van maatregelen zoals meer bewegingsvrijheid buiten de instelling en opheffen van andere ingestelde vrijheidsbeperkende maatregelen. Verdere versoepeling is alleen mogelijk indien de basishygiëne op de afdeling aantoonbaar op orde is en deze tevens te intensiveren is (schoonmaak, handhygiëne et cetera).
Medewerkers
Voor medewerkers zonder huidafwijkingen die in een contactonderzoek MRSA-positief testen is een werkverbod in de patiëntenzorg tenminste van toepassing tot de uitslag van typering bekend is, mits direct gestart wordt met MRSA-dekolonisatie therapie. Medewerkers met een huidafwijking ondergaan eerst een behandeling voor de huidafwijking door de bedrijfsarts en starten daarna met dekolonisatietherapie. Dit is doorgaans in overleg met arts-microbioloog (zie SWAB-richtlijn Behandeling MRSA-dragers).
Het werkverbod blijft opgeheven tenzij er sprake is van een van onderstaande kenmerken:
- huidafwijkingen zoals (chronisch/opvlammend) eczeem en/of chronische wonden en/of
- een epidemische of PVL-positieve MRSA-stam is aannemelijk op basis van klinisch epidemiologische informatie en/of
- medewerker is bewezen onderdeel van een MRSA-cluster in de zorg.
In dat geval is er opnieuw sprake van een patiëntgebonden werkverbod dat pas wordt opgeheven als na beëindiging van een dragerschapsbehandeling drie opeenvolgende MRSA-sets met een tussenpoos van minimaal zeven dagen negatief zijn, tenzij de besmettingskans tot zeer gering kan worden teruggebracht, aangezien voldaan wordt aan de hieronder beschreven voorwaarden. Echter, als er sprake is van ongecompliceerd dragerschap en de MRSA-inventarisatiekweken die afgenomen zijn direct voorafgaand aan start van de behandeling uiteindelijk negatief blijken te zijn, dan mag het werkverbod opgeheven worden zodra deze uitslag bekend is. Er kan sprake zijn van een tijdelijke besmetting met MRSA die meestal de volgende dag verdwenen is. Het blijft echter noodzakelijk om driemaal negatief te testen op MRSA na beëindiging van de dragerschapsbehandeling (die wel moet worden uitgevoerd en afgemaakt). Dit geldt ook bij ongecompliceerd dragerschap. Na minimaal twee en twaalf maanden na het opheffen van het patiëntgebonden werkverbod wordt de medewerker opnieuw getest op de aanwezigheid van MRSA.
Het komt echter voor dat MRSA-dekolonisatietherapie bij MRSA-positieve medewerkers, soms na diverse pogingen, niet succesvol is waardoor zij langdurig niet inzetbaar zijn in de directe patiëntenzorg. Het is uiteindelijk aan de zorginstelling om te besluiten of een chronische MRSA-drager onder voorwaarden werkzaam kan blijven in de directe patiëntenzorg, waarbij een afweging gemaakt dient te worden tussen patiëntveiligheid en personeelsbeleid. Bij deze afweging kunnen de volgende argumenten worden meegenomen.
- De besmettingskans kan onder de volgende voorwaarden tot zeer gering worden teruggebracht:
- De medewerker ondergaat op indicatie (bij afwezigheid van contra-indicaties zoals uitgebreide huidlaesies of persisterende blootstelling) een MRSA-dragerschapsbehandeling.
- De medewerker heeft geen huidafwijkingen zoals bijvoorbeeld (chronisch/opvlammend) eczeem en/of chronische wonden.
- De medewerker meldt het bij de bedrijfsarts indien er huidafwijkingen ontstaan.
- De medewerker is geen drager van een epidemische stam en/of stam die PVL-positief is.
- De medewerker committeert zich aan bron- en contactonderzoek.
- Het belang van behoud van personeel dat niet gemist kan worden binnen de directe patiëntenzorg.
- Vergroten van het draagvlak voor het MRSA-beleid, waaronder deelname aan bron en contactonderzoek, onder medewerkers
Hier kan maatwerk worden toegepast in overleg met de bedrijfsarts, arts-microbioloog en/of internist-infectioloog en/of deskundige infectiepreventie.
De prevalentie van MRSA onder de bevolking bedraagt 0.03-0.17% (Weterings, 2019). Dat suggereert dat ook van de zorgverleners een klein deel gekoloniseerd kan zijn met MRSA zonder dat het bekend is en zonder dat gerichte maatregelen genomen worden om transmissie te voorkomen. Dat aantal onbekend MRSA-positieve medewerkers zal waarschijnlijk hoger zijn dan het aantal medewerkers dat ondanks diverse dekolonisatie pogingen MRSA-positief blijft en derhalve een groter risico vormen voor transmissie van MRSA dan de bekend MRSA-positieve medewerkers bij wie een vinger aan de pols gehouden wordt zodat een inschatting van het risico op transmissie kan worden gemaakt. Vanuit principe van proportionaliteit is het niet passend om de zorgverleners met persisterend MRSA-dragerschap per definitie de toegang tot patiëntgebonden zorg te ontzeggen. Maatwerk zoals beschreven is geboden naar de mening van de werkgroep.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers) en medewerkers
Isolatiemaatregelen hebben veel impact op de patiënt en zorgmedewerkers, met name in de thuissituatie en in geval van veel opnames en/of invasieve onderzoeken. Daarnaast kunnen isolatiemaatregelen als stigmatiserend worden ervaren. Het is belangrijk om het draagvlak voor het MRSA-beleid te behouden en de drempel voor medewerkers te verlagen om zich te committeren aan bron en contactonderzoek. De in deze richtlijn beschreven maatregelen dienen de bescherming en veiligheid van de medepatiënten.
Kosten (middelenbeslag)
Vanwege het actieve zoeken naar MRSA via het screeningsbeleid, en het gematigd toepassen van antibiotica komt MRSA in Nederland weinig voor, vergeleken met andere landen (zie module 1). De belasting van de maatregelen uit het nationaal beleid wegen op tegen de beoogde risicoreductie. Het search and destroy beleid blijkt kosteneffectief en draagt bij aan een afname in sterfte door MRSA-infectie (Souverein 2016).
Aanvaardbaarheid, haalbaarheid en implementatie
Het huidige search and destroy beleid wordt al jaren succesvol uitgevoerd en blijkt kosteneffectief. De werkgroep verwacht daarom geen problemen met betrekking tot de aanvaardbaarheid, haalbaarheid en implementeerbaarheid van de aanbevelingen.
Onderbouwing
Autorisatiedatum: 20 november 2023
Eerstvolgende beoordeling actualiteit: 2025
Geautoriseerd door:
- Nederlandse Vereniging voor Heelkunde (NVvH)
- Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Nederlandse Vereniging van Internist-Infectiologen (NIV/NVII)
- Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg (VHIG)
- Rijksinstituut voor Volksgezondheid en Milieu (RIVM)
- Vereniging van specialisten ouderengeneeskunde (Verenso)
- Nederlandse Vereniging Artsen Verstandelijk Gehandicapten (NVAVG)
- Nederlandse Vereniging voor Anesthesiologen (NVA)
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB)
- Patiëntfederatie Nederland (PFNL)
- Nederlandse Vereniging van Revalidatieartsen (VRA)
- Nederlands Oogheelkundig gezelschap (NOG)
- Nederlandse Vereniging voor Radiologie (NVvR)
- Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV)
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (NVALT)
- Nederlandse Vereniging voor Intensive Care (NVIC)
- Vereniging Klinische Genetica Nederland (VKGN)
- Nederlandse Vereniging voor Pathologie (NVVP)
- Vereniging voor Sportgeneeskunde (VSG)
- Nederlandse Vereniging voor Plastische Chirurgie (NVPC)
- Nederlandse Vereniging voor Orthopedie (NOV)
- Nederlandse Vereniging van Ziekenhuisapothekers (NVZA)
- Nederlandse Vereniging voor Klinische Geriatrie (NVKG)
- Nederlandse Vereniging voor Reumatologie (NVR)
- Nederlandse Vereniging van Maag, Darm-Leverartsen (NVMDL)
Regiehouder:
- Samenwerkingsverband Richtlijnen Infectiepreventie (SRI)
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd door het ministerie van VWS (Ministerie van Volksgezondheid, Welzijn en Sport). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel van deze module is te beschrijven wanneer beschermende maatregelen met betrekking tot MRSA (meticilline-resistente Staphylococcus aureus ) bij patiënten en medewerkers kunnen worden opgeheven.
The WIP-guidelines ’Meticilline-resistente Staphylococcus aureus (MRSA)’, relevant international guidelines and relevant scientific articles were examined in order to answer the clinical question. No systematic literature analysis was performed for this clinical question because the nature of this question does not lend itself well to be an answer by means of a systematic review of original scientific research.
Not applicable.
Ammerlaan HS, Kluytmans JA, Berkhout H, Buiting A, de Brauwer EI, van den Broek PJ, van Gelderen P, Leenders SA, Ott A, Richter C, Spanjaard L, Spijkerman IJ, van Tiel FH, Voorn GP, Wulf MW, van Zeijl J, Troelstra A, Bonten MJ; MRSA (meticilline-resistente Staphylococcus aureus ) Eradication Study Group. Eradication of carriage with methicillin-resistant Staphylococcus aureus: effectiveness of a national guideline. J Antimicrob Chemother. 2011 Oct;66(10):2409-17. Doi: 10.1093/jac/dkr243. Epub 2011a Jun 30. PMID: 21719473.
Kluytmans-van den Bergh MF, Vos MC, Diederen BM, Vandenbroucke-Grauls CM, Voss A, Kluytmans JA; Dutch working group on the laboratory detection of highly resistant microorganisms. Dutch guideline on the laboratory detection of methicillin-resistant Staphylococcus aureus. Eur J Clin Microbiol Infect Dis. 2014 Jan;33(1):89-101. doi: 10.1007/s10096-013-1933-6. Epub 2013 Jul 27. PMID: 23893016.
Nellums LB, Thompson H, Holmes A, Castro-Sánchez E, Otter JA, Norredam M, Friedland JS, Hargreaves S. Antimicrobial resistance among migrants in Europe: a systematic review and meta-analysis. Lancet Infect Dis. 2018 Jul;18(7):796-811. Doi: 10.1016/S1473-3099(18)30219-6. Epub 2018 May 17. PMID: 29779917; PMCID: PMC6032478.
NethMap 2021: Consumption of antimicrobial agents and antimicrobial resistance among medically important bacteria in the Netherlands in 2020 / MARAN 2021. Monitoring of Antimicrobial Resistance and Antibiotic Usage in Animals in the Netherlands in 2020.
Ravensbergen SJ, Berends M, Stienstra Y, Ott A. High prevalence of MRSA and ESBL among asylum seekers in the Netherlands. PloS One. 2017 Apr 25;12(4):e0176481. Doi: 10.1371/journal.pone.0176481. PMID: 28441421; PMCID: PMC5404783.
Ravensbergen SJ, Louka C, Ott A, Rossen JW, Cornish D, Pournaras S, Bathoorn E, Stienstra Y. Proportion of asylum seekers carrying multi-drug resistant microorganisms is persistently increased after arrival in the Netherlands. Antimicrob Resist Infect Control. 2019 Jan 7;8:6. Doi: 10.1186/s13756-018-0455-5. PMID: 30637100; PMCID: PMC6323800.
Souverein D, Houtman P, Euser SM, Herpers BL, Kluytmans J, Den Boer JW. Costs and Benefits Associated with the MRSA Search and Destroy Policy in a Hospital in the Region Kennemerland, The Netherlands. PloS One. 2016;11(2):e0148175. Published 2016 Feb 5. Doi:10.1371/journal.pone.0148175.
van Rijen MM, Bosch T, Heck ME, Kluytmans JA. Meticillin-resistant Staphylococcus aureus epidemiology and transmission in a Dutch hospital. J Hosp Infect. 2009 Aug;72(4):299-306. Doi: 10.1016/j.jhin.2009.05.006. Epub 2009 Jul 10. Erratum in: J Hosp Infect. 2010 Feb;74(2):198. PMID: 19596488.
Vos MC, Ott A, Verbrugh HA. Successful search-and-destroy policy for methicillin-resistant Staphylococcus aureus in The Netherlands. J Clin Microbiol. 2005 Apr;43(4):2034; author reply 2034-5. Doi: 10.1128/JCM.43.4.2034-2035.2005. PMID: 15815056; PMCID: PMC1081402.
Vos MC, Behrendt MD, Melles DC, Mollema FP, de Groot W, Parlevliet G, Ott A, Horst-Kreft D, van Belkum A, Verbrugh HA. 5 years of experience implementing a methicillin-resistant Staphylococcus aureus search and destroy policy at the largest university medical center in the Netherlands. Infect Control Hosp Epidemiol. 2009 Oct;30(10):977-84. Doi: 10.1086/605921. PMID: 19712031.
Wassenberg MW, Hopmans TE, Troelstra A, Kluytmans JA, Bonten MJ. Methicillin-resistant Staphylococcus aureus of livestock origin in Dutch hospitals: high-risk patients need only to be investigated if admitted to hospital. Ned Tijdschr Geneeskd. 2008 Dec 6;152(49):2681-8. Dutch. PMID: 19137969.
Wertheim HF, Vos MC, Boelens HA, Voss A, Vandenbroucke-Grauls CM, Meester MH, Kluytmans JA, van Keulen PH, Verbrugh HA. Low prevalence of methicillin-resistant Staphylococcus aureus (MRSA) at hospital admission in the Netherlands: the value of search and destroy and restrictive antibiotic use. J Hosp Infect. 2004 Apr;56(4):321-5. Doi: 10.1016/j.jhin.2004.01.026. PMID: 15066745.
Weterings V, Veenemans J, van Rijen M, Kluytmans J. Prevalence of nasal carriage of methicillin-resistant Staphylococcus aureus in patients at hospital admission in The Netherlands, 2010-2017: an observational study. Clin Microbiol Infect. 2019 Nov;25(11):1428.e1-1428.e5. doi: 10.1016/j.cmi.2019.03.012. Epub 2019 Mar 27. PMID: 30928560.
Bijlagen
|
ABR-Zorgregio |
Netwerk van zorginstellingen met als doel antibioticaresistentie te voorkomen en verspreiding te bestrijden door afspraken te maken op regionaal niveau. |
|---|---|
|
Arts VG |
Arts verstandelijk gehandicapten |
|
Cohort-verpleging |
Het verplegen van meerdere patiënten in één of meerdere ruimtes bij elkaar met identieke isolatiemaatregelen. Persoonlijke beschermingsmiddelen worden bij elke patiënt vervangen (eilandverpleging). Niet alle persoonlijke beschermingsmaatregelen worden gewisseld. Een mondneusmasker en schort mogen langere tijd achter elkaar gedragen worden. |
|
Einddesinfectie |
Het desinfecteren, voorafgegaan door reinigen, van de ruimte (oppervlakken, tastvlakken, vloer, spatzones muur) inclusief het sanitair en van alle herbruikbare materialen die in de ruimte aanwezig zijn (zoals afstandsbediening, bedgordijnen). Einddesinfectie vindt plaats na ontslag van categorie-1-patiënten en bij categorie-2-patiënten indien de uitslag van de MRSA-test niet bekend is op het moment van ontslag of overplaatsing. In de langdurige zorg vindt einddesinfectie ook plaats op de laatste dag van eradicatiebehandeling. Einddesinfectie is van toepassing voor zowel patiëntenkamers (waar de patiënt slaapt) en klinische behandelruimtes. |
|
Epidemische stam |
MRSA-stam die zich in een zorginstelling/zorgsetting heeft verspreid (verspreiding tussen zorg gerelateerde contacten). |
|
Eradicatie |
Het vrijmaken van MRSA door dragerschapsbehandeling. |
|
Huisgenoten |
Personen die overdag en ‘s nachts in hetzelfde huis als de index-persoon verblijven en ruimten zoals badkamer, woonkamer of keuken gemeenschappelijk gebruiken. |
|
Invasieve ingreep |
Een operatie of het plaatsen of inbrengen van lichaamsvreemde materialen die een verbinding vormen tussen milieu interieur en exterieur zoals drain, een urinekatheter, scoop, centraalveneuze infuuskatheter, arteriële infuuskatheter of externe fixateur. |
|
Kolonisatie |
Het zich vestigen en vermenigvuldigen van micro-organismen op huid of slijmvliezen, zonder schade of hinder voor de gastheer. |
|
Infectie |
Interactie tussen het micro-organisme en de gastheer leidt tot schade of een veranderde fysiologie bij de gastheer. De schade of veranderde fysiologie kan resulteren in klinisch waarneembare symptomen en verschijnselen, maar ook langdurig onopgemerkt blijven of subklinisch verlopen. |
|
LA-MRSA |
Diergerelateerde meticilline-resistente Staphylococcus aureus (livestock-associated meticilline-resistente Staphylococcus aureus). LA-MRSA is gedefinieerd als ST398 in combinatie met een duidelijke expositie aan vee. |
|
LCI (Landelijke Coördinatie Infectieziektebestrijding (onderdeel RIVM)) |
Landelijke Coördinatie Infectieziektebestrijding |
|
Medewerker |
Medewerker en gastmedewerker in zorginstelling. Hieronder wordt iedereen verstaan die, al dan niet betaald, zorg verleent. |
|
MRSA |
Meticilline-resistente Staphylococcus aureus. |
|
MRSA-drager |
Een individu bij wie MRSA is vastgesteld onafhankelijk van de locatie op of in het lichaam of de hoeveelheid MRSA. |
|
MRSA-epidemie |
Twee of meer patiënten in een zorginstelling zijn gekoloniseerd of geïnfecteerd met dezelfde MRSA-stam. De patiënten hebben een verband in tijd en plaats en er is geen gemeenschappelijke bron buiten de zorginstelling. |
|
MRSA-positief |
Zie MRSA-drager |
|
MRSA risicocategorie (patiënt/medewerker) |
Risicocategorie op basis van het risico op overdracht van MRSA naar anderen:
|
|
MRSA-stam |
Isolaten die volgens een standaard typeringsmethode tot hetzelfde type behoren. |
|
MRSA-test |
De detectie van MRSA berust op de aanwezigheid van het species Staphylococcus aureus en op de aanwezigheid van het mec-A-gen dat codeert voor de aanmaak van een gemodificeerd penicilline-bindend eiwit (PBP-2a). Dit eiwit heeft een verminderde affiniteit voor betalactam antibiotica, waardoor deze groep antibiotica onwerkzaam worden. |
|
OMT |
Outbreak management team |
|
Onbeschermd contact |
Contact met een MRSA-drager waarbij geen of onvoldoende beschermende maatregelen zijn genomen. |
|
Ongecompliceerde MRSA drager |
Individu bij wie MRSA is vastgesteld zonder actieve infectie en:
|
|
Patiënt/Cliënt/Bewoner |
Is een persoon die voor diagnostiek en/of behandeling in het ziekenhuis of andere zorginstelling komt of woonachtig is (dit kan klinisch of poliklinisch zijn). |
|
Polikliniek |
Omvat alle afdelingen waar onderzoek en behandeling plaatsvindt van patiënten met aandoeningen en ziekten waarvoor specialistische kennis en hulpmiddelen nodig zijn én die niet als klinische afdelingen zijn aangeduid. De indeling van de afdelingen die hieronder vallen moet door het ziekenhuis op basis van de invasiviteit van de ingrepen gemaakt worden. |
|
Ringonderzoek |
De meest nabije contacten van de patiënt/cliënt worden eerst onderzocht. Als daar besmetting wordt vastgesteld, wordt het onderzoek uitgebreid naar minder nabije contacten. |
|
RIVM (Rijksinstituut voor Volksgezondheid en Milieu ) |
Rijksinstituut voor Volksgezondheid en Milieu. |
|
SWAB |
Stichting Werkgroep Antibioticabeleid. |
|
Transmissie |
Overdracht van micro-organismen. |
|
Vluchtelingenopvang |
Iedere vorm van locatie voor vluchtelingenopvang waar vluchtelingen woonachtig zijn tot de overgang naar een definitieve woning . |
Werkwijze
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II-instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met MRSA (meticilline-resistente Staphylococcus aureus ). De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (MRSA) ziekenhuizen’, ‘MRSA, thuiszorg’, ‘MRSA verpleeghuizen’, MRSA verzorgingshuizen’ en ‘MRSA revalidatiecentra’ op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door RIVM (Rijksinstituut voor Volksgezondheid en Milieu ), VHIG (Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg ), IGJ, NVZ, VDSMH (Vereniging Deskundigen Steriele Medische Hulpmiddelen ), en PFNL (Patiëntfederatie Nederland ) via de invitational conference. Een verslag hiervan is als 'Rapportage Knelpunteninventarisatie' opgenomen onder 'Bijlagen'. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder ‘Onderbouwing’. Indien mogelijk werden de data uit verschillende studies gepoold in een random-effects-model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE (Grading Recommendations Assessment, Development and Evaluation )-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt)relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen. (De domeinen voor downgraden zijn: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias. De domeinen voor upgraden zijn: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|---|---|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID (Minimal Clinically Important Difference )). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|---|---|---|
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntfederatie Nederland (PFNL) voor de invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan PFNL en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz (Wet kwaliteit, klachten en geschillen zorg ) & kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn. Zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|---|---|---|
|
Module 1 Achtergrond en epidemiologie |
Geen substantiële financiële gevolgen |
Bij deze module zijn geen aanbevelingen geformuleerd. |
|
Module 2 Risicocategorieën |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 3 Isolatie en Infectiepreventiemaatregelen |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 4 opheffen beschermende maatregelen |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 5 Organisatie van Zorg |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ.2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. (Medisch specialistische richtlijnen 2.0 (PDF)).
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from https://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Dit implementatieplan is opgesteld om de implementatie van de aanbevelingen in de richtlijn infectiepreventie meticilline-resistente Staphylococcus aureus (MRSA) te borgen. Voor het opstellen van dit plan heeft de werkgroep per ontwikkelde module beoordeeld wat eventueel bevorderende en belemmerende factoren zijn voor het naleven van de aanbevelingen en wat eventueel nodig is om de aanbevolen infectiepreventiemaatregelen in Nederland te implementeren.
Werkwijze
De werkgroep heeft per aanbeveling binnen de modules geïnventariseerd:
- wat een realistische termijn voor implementatie is;
- de verwachtte effect van implementatie op de zorgkosten;
- de randvoorwaarden om de aanbeveling tijdig te implementeren;
- de mogelijk barrières voor implementatie;
- te ondernemen acties voor (bevordering van) implementatie;
- de verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbevelingen is nagedacht over de hierboven genoemde punten. Echter, niet voor iedere aanbeveling leverde bovengenoemde inventarisatie bruikbare antwoorden op. Aangezien het merendeel van de aanbevelingen in deze richtlijn gebaseerd is op expert opinion en/of een beperkte bewijskracht, is een duidelijke uitspraak over het implementeren niet voor alle aanbevelingen mogelijk noch gewenst. Bovengenoemde inventarisatie is daarom beperkt tot die aanbevelingen waarvoor bovengenoemde analyse zinvol werd geacht.
Hieronder is een tabel (tabel 1) opgenomen met alle modules uit deze richtlijn met daarbij de bijhorende implementatietermijn, verwacht effect op kosten, mogelijke barrières voor implementatie, te ondernemen acties voor implementatie en verantwoordelijken voor de acties.
Tabel 1. Implementatieplan
|
Module |
Tijdspad voor implementatie |
Verwacht effect op de kosten |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijke voor acties3 |
|---|---|---|---|---|---|
|
Achtergrond en epidemiologie |
n.v.t |
n.v.t |
n.v.t |
n.v.t |
n.v.t |
|
Risicocategorieën |
<1 jaar |
Geen, dit betreft grotendeels bestaand beleid |
Geen |
Verspreiden richtlijn |
Professionals |
|
Isolatie en infectiepreventiemaatregelen |
<1 jaar |
Veranderingen ten aanzien van het huidige beleid betreft een versoepeling met betrekking tot het opheffen van maatregelen voor medewerkers welke een geringe positieve uitwerking hebben op de personele bezetting in zorginstellingen. |
Geen |
Verspreiden richtlijn |
Professionals |
|
Opheffen van beschermende maatregelen |
<1 jaar |
Geen, dit betreft bestaand beleid |
Geen |
Verspreiden richtlijn |
Professionals |
|
Organisatie van zorg |
<1 jaar |
Geen, dit betreft bestaand beleid |
Geen |
Verspreiden richtlijn |
Professionals |
1 Barrières kunnen zich bevinden op het niveau van de professional, op het niveau van de organisatie (het ziekenhuis) of op het niveau van het systeem (buiten het ziekenhuis). Denk bijvoorbeeld aan onenigheid in het land met betrekking tot de aanbeveling, onvoldoende motivatie of kennis bij de specialist, onvoldoende faciliteiten of personeel, nodige concentratie van zorg, kosten, slechte samenwerking tussen disciplines, nodige taakherschikking, et cetera.
2 Denk aan acties die noodzakelijk zijn voor implementatie, maar ook acties die mogelijk zijn om de implementatie te bevorderen. Denk bijvoorbeeld aan controleren aanbeveling tijdens kwaliteitsvisitatie, publicatie van de richtlijn, ontwikkelen van implementatietools, informeren van ziekenhuisbestuurders, regelen van goede vergoeding voor een bepaald type behandeling, maken van samenwerkingsafspraken.
3 Wie de verantwoordelijkheden draagt voor implementatie van de aanbevelingen, zal tevens afhankelijk zijn van het niveau waarop zich barrières bevinden. Barrières op het niveau van de professional zullen vaak opgelost moeten worden door de beroepsvereniging. Barrières op het niveau van de organisatie zullen vaak onder verantwoordelijkheid van de ziekenhuisbestuurders vallen. Bij het oplossen van barrières op het niveau van het systeem zijn ook andere partijen, zoals de NZA en zorgverzekeraars, van belang. Echter, aangezien de richtlijn vaak enkel wordt geautoriseerd door de participerende wetenschappelijke verenigingen is het aan de wetenschappelijke verenigingen om deze problemen bij de andere partijen aan te kaarten
Termijn voor implementatie
Omdat de aanbevelingen in het algemeen nauw aansluiten bij de huidige klinische praktijk, voorziet de werkgroep nauwelijks belemmeringen voor implementatie. Als men ervan uitgaat dat alle betrokken zorgprofessionals vanaf autorisatie van deze richtlijn (voorzien voorjaar 2024) binnen een jaar op de hoogte gesteld worden van deze richtlijn, is implementatie van de aanbevelingen vanaf een jaar later (voorjaar 2025) realistisch en haalbaar.
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
- Alle direct betrokken wetenschappelijke verenigingen/beroepsorganisaties
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn door er over te vertellen op congressen.
- Ontwikkelen van gerichte bijscholing/trainingen om kennisoverdracht tussen medewerkers te faciliteren/stimuleren.
- Ontwikkelen en aanpassen van infectiepreventieprotocollen.
- De lokale vakgroepen/individuele medisch professionals
- Het bespreken van de aanbevelingen in de multidisciplinaire teamoverleggen, vakgroepoverleggen en relevante lokale werkgroepen.
- Aanpassen lokale infectiepreventieprotocollen en alle werkinstructies waar iets over MRSA (meticilline-resistente Staphylococcus aureus ) in is opgeschreven.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
- Samenwerkingsverband Richtlijnen Infectiepreventie (SRI):
- Toevoegen van de richtlijn aan de SRI (Samenwerkingsverband Richtlijnen Infectiepreventie )-website.
- Toevoegen van richtlijn aan de Richtlijnendatabase van de Federatie Medisch Specialisten.
- Het implementatieplan wordt in de bijlage opgenomen, zodat deze voor op een voor alle partijen goed te vinden is.
- De kennislacunes worden opgenomen in de bijlagen.
Indicatoren
Voor deze richtlijn zijn geen indicatoren ontwikkeld.
Tijdens de ontwikkeling van de richtlijn Infectiepreventie meticilline-resistente Staphylococcus aureus (MRSA) is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde zoekvragen is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based methodiek (EBRO) is duidelijk geworden dat er nog kennislacunes bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk. Om deze reden heeft de werkgroep per module aangegeven waar wetenschappelijke kennis beperkt is en dus op welke vlakken nader onderzoek gewenst is.
- Module 1 Achtergrond en epidemiologie: Geen systematische search uitgevoerd.
- Module 2 Risicocategorieën: Het is onduidelijk of en zo ja welke reizigers een verhoogd risico hebben op MRSA (meticilline-resistente Staphylococcus aureus )-dragerschap en bij opname gescreend moeten worden.
- Module 3 Isolatie en infectiepreventiemaatregelen: Zijn LA-MRSA-stammen minder ziekmakend zijn dan niet-LA-MRSA-stammen?
- Module 4 Opheffen beschermende maatregelen: Geen systematische search uitgevoerd.
- Module 5 Organisatie van Zorg: Geen systematische search uitgevoerd.
Notulen invitational conference richtlijn MRSA (meticilline-resistente Staphylococcus aureus )
Datum: 4 oktober 2021
Tijd: 17:00-19:00 uur
Locatie: Online via Zoom
Aanwezig: Willeke Gerritsen (RIVM), Liesbeth Boeijen (VHIG), Hedy Salomons, Stephanie Hulsbosch (IGJ), Erica de Loos (NVZ), Gerjanne Vlasveld (NVAVG), Jan Vissers (Verenso), Jannie Smit (VDSMH), Thomas Jonkergouw (PFN), René Naber (NVAB), Andreas Voss (FMS), Anneloes Vlek (NVMM, voorzitter), Bart Versteeg, Haitske Graveland (KIMS)
Genodigd maar niet aanwezig: Overige WVen aangesloten bij FMS (Federatie Medisch Specialisten ), NFU, STZ, NAPA (Nederlandse Associatie Physician Assistants ), ZiNL, ZN, ZorgthuisNL, V&VN (Verpleegkundigen en Verzorgenden Nederland ), NCvB, NVvAKI, VSG, NVTNET, NVU, NVZA (Nederlandse Vereniging van Ziekenhuisapothekers )
1. Opening
Opening om 17:00 uur door Anneloes Vlek (voorzitter van de werkgroep). Iedereen wordt hartelijk welkom geheten.
2. Voorstelronde (naam, organisatie en functie)
Er wordt een kort voorstelrondje gemaakt
3. Toelichting doel van de avond en proces richtlijnontwikkeling:
Bart Versteeg licht toe dat de richtlijn onderdeel is van het SRI (Samenwerkingsverband Richtlijnen Infectiepreventie ). De structuur wordt kort besproken. Doel van de avond is het verzamelen van input van verschillende partijen om uiteindelijk een complete richtlijn op te stellen. Hierbij wordt rekening gehouden met wat de stakeholders belangrijk vinden en wat er leeft. Hier zal bepaald worden welke punten wel en welke niet worden meegenomen in de richtlijn. Het zal een multidisciplinaire richtlijn worden met een plan de implementatie te verbeteren, welke aansluit op de praktijk en de bestaande zorgprocessen.
De doelstelling is het ontwikkelen van een multidisciplinaire, helder afgebakende richtlijn waarin de patiënt centraal staat.
4. Impact probleem persoonlijke beschermingsmiddelen en richtlijn
Meticilline-resistente Staphylococcus aureus (MRSA) werd voor het eerst gemeld in 1961, binnen 1 jaar na de introductie van meticilline. Snel daarna werden de eerste epidemieën met MRSA gerapporteerd. Sinds de jaren 70 is er een toename van de problematiek in Europa en de Verenigde Staten waar te nemen. In de meeste landen is het percentage MRSA bij ziekenhuispatiënten nu hoger dan 20%. In sommige landen worden zelfs percentages van hoger dan 50% gemeld. Nederland is in staat gebleken om het percentage MRSA te beperken (<1%). Dit wordt mede bereikt dankzij succesvol nationaal beleid dat zal worden herzien in deze richtlijn.
Afstemming tussen verschillende SRI-richtlijnen is van groot belang. Voor de gebruiker moet informatie makkelijk vindbaar zijn. Zo zal bijvoorbeeld worden afgestemd met de isolatierichtlijn over MRSA en isolatiemaatregelen: hebben afzonderlijke maatregelen evenveel toegevoegde waarde (ook in verschillende settings/zorgdomeinen)? En over MRSA en reiniging en desinfectie met de richtlijn Reiniging & desinfectie van ruimten, meubilair en voorwerpen (specifieke methoden).
5. Bespreken raamwerk & prioriteiten (afbakening en inhoudelijke hoofdlijnen van de richtlijn)
Stephanie Hulzebosch (IGJ) geeft aan dat de benoemde knelpunten in het raamwerk herkenbaar zijn. In de praktijk worden knelpunten ervaren omtrent de omschrijving van de risicocategorieën met name de V-MRSA. Hoe ga je om met V-gerelateerde MRSA? Zijn alle maatregelen dan echt noodzakelijk.
Een ander knelpunt is de nut en noodzaak van isolatiemaatregelen. Voor particuliere klinieken is vaak niet duidelijk wat gezien moet worden als een klinische of poliklinische setting.
Hedy Salomons (IGJ) geeft aan dat bij de inspecties die worden uitgevoerd met name aan de orde komt wat nou moet worden gezien als invasief. Hier zijn verschillende definitie voor en dat levert veel vragen op. Op dit punt is er behoeft is aan duidelijkheid zodat minder wordt overgelaten aan de individuele zorgaanbieder.
Een ander knelpunt betreft artsen die deels in Nederland deels in het buitenland (bijvoorbeeld België) werken. Hoe ga je met deze groep om die een soort blijvende blootstelling ervaren?
Tenslotte heeft het de voorkeur om ook andere reinigingsmethoden dan chloor en alcohol te bespreken (bijvoorbeeld UV-licht en waterstofperoxide). Deze worden in de praktijk nu al wel toegepast, maar zijn nog niet in richtlijnen opgenomen.
Willeke Gerritsen (RIVM) geeft aan dat één van de knelpunten betrekking heeft op hoe om te gaan met een medisch kinderdagverblijf of een school voor speciaal onderwijs waar ook kinderen met medische problemen naar toe gaan. Kunnen daar iets meer handvaten aan gegeven worden? Hetzelfde geld ook voor de wijkverpleging.
Een andere vraag die speelt is wie is waarvoor verantwoordelijk. Stel we hebben een medewerker die MRSA-positief is. Wie gaat dan de behandeling geven? Nu wordt de medewerker vaak van het kastje naar de muur gestuurd.
Anneloes geeft aan dat het belangrijk is hierbij te kijken naar de overlap met andere richtlijnen. Afstemming is hierbij gewenst.
Liesbeth Boeien (VHIG) geeft aan dat het inderdaad belangrijk om te kijken hoe het met gastchirurgen gaat, maar ook de risico-inventarisatie. Daarnaast is er een knelpunt vanuit de verpleeghuizen waar het de vraag is hoe om te gaan met langdurig dragerschap. Hoe moet hier mee om worden gegaan, waar kan men terecht en wanneer kunnen maatregelen worden losgelaten of afgebouwd.
Jan Vissers (Verenso) geeft aan dat eerdergenoemde punten worden herkend. Wie heeft welke rol en wanneer. Communicatie onderling is ook erg belangrijk tussen ziekenhuizen en mensen thuis.
Een ander knelpunt dat wordt ervaren is betreft eenduidigheid in beleid. Soms ontvang je van verschillende microbiologen verschillende adviezen, maar ook wie heeft welke rol met betrekking tot de medewerker waarbij de bedrijfsarts verwijst naar de organisatie, organisatie overlegt met de microbioloog en microbioloog verwijst naar de bedrijfsarts. Hierdoor blijven medewerkers in rondjes lopen. Daarnaast is er behoefte aan duidelijkheid over regionale verschillen. In Limburg is bijvoorbeeld meer sprake van V-MRSA dan andere regio’s.
René Naber (NVAB) geeft aan dat het belangrijk is om een goede uitsplitsing te hebben tussen patiënten en werknemers. In de LCI (Landelijke Coördinatie Infectieziektebestrijding (onderdeel RIVM))-richtlijn (2018) wordt ook al veel gezegd over MRSA buiten het ziekenhuis. Tenslotte is het belangrijk de verantwoordelijkheden goed te benoemen in het ziekenhuis heb je voor de patiënt de medisch specialist, de werknemer valt weer onder de bedrijfsarts. In de wijkverpleging is de huisarts degene die voor de patiënten van belang is, maar in het verpleeghuis kan dit weer de specialist ouderen geneeskunde of de huisarts zijn.
Duidelijkheid over V-MRSA is belangrijk. Als medewerker in Achterhoek kom je veel in aanraking met V-MRSA. Als werknemer mag je werken, maar als je vervolgens als patiënt wordt opgenomen, moet je in isolatie. Dit roept vragen op, is onduidelijk.
Jannie Smit (VDSMH) geeft aan dat het voor de CSA (sterilisatieafdeling) niet uitmaakt of gebruikte materialen MRSA-positief zijn, en dat dit niet als zodanig gelabeld hoeft te worden als dit aangeboden wordt voor verwerking.
Gerjanne Vlasveld (NVAVG) geeft aan dat ze zich kan vinden in voorgaande reacties. Ook de LCI-richtlijn (MRSA buiten de ziekenhuizen) is weinig concreet, zeker wat betreft medisch kinderdagverblijven en andere gedecentraliseerde zorg. Dit geldt ook voor de overlap tussen zorg en wonen. In gehandicapten- en ouderenzorg wonen mensen. Dit maakt situatie nog wel eens ingewikkeld als zij uit het buitenland terugkomen of langdurig drager zijn. Behoefte aan concrete adviezen in deze situatie. Nu wordt er vooral gemerkt dat er maatwerk moet worden toegepast.
Erica de Loos (NVZ) geeft aan dat de NVZ niet zozeer medisch inhoudelijk kijkt, maar meer naar de naar de implementatie en naleving van de richtlijn voor medisch specialistische zorginstellingen. Het is van belang om bij de aanbevelingen en het implementatieplan aan te geven wat het verschil is in de nieuwe situatie ten opzichte van de oude situatie. Dit maakt het makkelijker is om te beoordelen wat de impact is op financiën, ICT of inzet van personeel. Als daar kosten of aantallen aan verboden zijn, is het van belang dat dit zo concreet mogelijk wordt uitgelegd.
→ Punt met betrekking tot governance-afspraak – categorie 2.
Er wordt afgesproken dat de NVZ (en NFU) tijdig worden geïnformeerd en er een overleg plaatsvindt nadat het raamwerk is afgerond. Tijdens dit overleg kan verder worden vastgesteld welke procedure, conform governance-afspraak, wordt ingezet.
Thomas Jonkergouw (PFN) geeft niet zozeer medische inhoudelijk naar de richtlijn te kijken. Een punt dat wel belangrijk is informatievoorziening. Hoe worden bezoek, naasten en gezinsleden tijdig geïnformeerd met name in instellingen waar mensen wonen.
Thomas geeft aan de richtlijn nog binnen de PFN voor te leggen, maar verwacht dat betrokkenheid van de PFN bij de enkel de commentaarfase voldoende moet zijn om het patiëntperspectief voldoende te borgen.
Liesbeth Boeijen (VHIG) geeft nog aan dat duurzaamheid is ook een belangrijk punt dat mogelijk in de richtlijn zou moeten worden benoemd.
René Naber (NVAB) geeft aan dat het ook goed zou zijn om bijzondere groepen te benoemen (zwangere, bewoners, mensen met verminderde afweer). Met name als ze werknemer zijn, maar natuurlijk ook als ze patiënt zijn.
6. Vervolgprocedure
De notulen van deze avond worden verspreid en er is gelegenheid tot commentaar of aanvullingen hierop. De werkgroep zal alle besproken knelpunten bespreken en een prioritering moeten maken (voor de richtlijn is maar beperkt budget en tijd beschikbaar, dus er zal een keuze gemaakt moeten worden). Met deze prioritering wordt het raamwerk voor de richtlijn opgesteld. Alle aanwezigen ontvangen de overwegingen voor prioritering en het raamwerk.
Als de conceptrichtlijn gereed is, zal deze ter commentaar aan alle genodigden worden verstuurd. Er is dan gelegenheid commentaar/suggesties te leveren. Dit commentaar wordt verwerkt in een voor autorisatie geschikte richtlijn. Autorisatie van de wetenschappelijke verenigingen in de kerngroep is nodig. Andere partijen krijgen de richtlijn ook ter informatie of autorisatie vastgesteld (procedures hiervoor verschillen per partij/vereniging).
7. Sluiting
Iedereen bedankt voor de komst en actieve participatie.